DVM. MSc. PhD. Liliana Revolledo Consultora.
[email protected]
[email protected]
Salmonella spp., pertenece al género Enterobactericeae, son bacterias anaerobias facultativas que causan infecciones localizadas o sistémicas y pueden llevar al estado de portador en una gran variedad de hospederos, incluyendo las aves y el hombre. Es un problema de animales de producción que causa graves pérdidas económicas especialmente en las aves donde se han tornado el vehículo más común para infecciones en humanos de salmonella.
En la década de los 80 y 90 hubo un gran aumento en la incidencia de Salmonella Enteritidis (SE) en brotes de salmonelosis humana en el Reino Unido, Europa Occidental y los Estados Unidos, y estos fueron atribuidos al consumo de carne de pollo y huevos contaminados o alimentos producidos con huevos. Muchas medidas fueron aplicadas para controlar estos brotes epidémicos, entre los que se incluyen legislaciones y reglamentos, actividades dirigidas a la inocuidad de los alimentos y programas de vacunaciones masivas y obligatorias, estas últimas liderados por la industria y utilizados en lotes de reproductoras pesadas y livianas, y en ponedoras. En Europa, estas medidas -especialmente la vacunación obligatoria- permitieron que después de 1997 hasta la fecha, el análisis temporal entre la reducción de brotes en humanos y los programas de vacunación realizados en aves demostrarán de una manera convincente que los programas de vacunación contribuyeron al beneficio y mejora de la salud pública en esas regiones.
VACUNACIONES Y VACUNAS
Vacunación es un concepto cuyo objetivo es imitar el desarrollo de la inmunidad adquirida por la inoculación de un microrganismo, de algunos componentes o partes no patógenas de un microrganismo, que al mismo tiempo estimulen eficazmente la respuesta inmune. Además de la mejora en la salud y en la productividad, las vacunas utilizadas en la prevención de Salmonella en las aves tienen un impacto significativo en la salud pública, pues de lo que se trata es reducir o minimizar el riesgo de que estos agentes se transmitan por los alimentos.
Muchas vacunas vivas atenuadas e inactivadas están disponibles comercialmente, y para algunas de estas cepas bacterianas la naturaleza de la atenuación no es conocida y poco o nada ha sido realizado para caracterizarlas. Un buen ejemplo de ello es la cepa 9R sin registro autorizado en muchos países de Europa por los problemas de identificación y diferenciación con las cepas de campo. No obstante, todos estos productos han sido probados con diferentes grados de eficacia en la prevención y control de brotes.
La vacunación ha sido utilizada en varias regiones del mundo con bastante éxito como una herramienta dentro de los programas de prevención y control, para las salmonelas hospedero-específicas (Salmonella Gallinarum y Salmonella Pullorum) para reducir la mortalidad especialmente en países donde estas enfermedades aún están presentes o han reaparecido, y en el caso de las salmonelas hospedero-inespecíficas (S. Enteritidis, S. Typhimurium, S. Heidelberg. y otras) para la reducción de la prevalencia en las aves con el objetivo de reducir el riesgo de infecciones en las personas.
Un requisito indispensable para la reducción o ausencia de excreción fecal, reducción de la diseminación vía heces, y en consecuencia reducción de la contaminación del medioambiente por Salmonella, sólo se consigue estimulando la SIgA (Inmunoglobulina A secretora) específica en las mucosas de los tractos digestivo y reproductivo. Esta estimulación en las mucosas, solamente se consigue con la estimulación a través de las mucosas, es decir productos aplicados por la vía oral, ocular o óculo-nasal, y con productos conteniendo cepas vivas que estimulan no sólo la producción de IgA secretora en las mucosas, sino que estimulan la respuesta inmune mediada por células y la inmunidad humoral.
Vacunas Inactivadas
Son productos que contienen la bacteria entera, que fue inactivada por diferentes métodos (formalina, acetona, glutaraldehído o tratamiento térmico), generalmente son elaborados con compuestos que estimulan el sistema inmune como adyuvantes oleosos, hidróxido de aluminio, u otros compuestos inmunoestimulantes. Estos productos son administrados por la inyección intramuscular o subcutáneamente. También conocidas como bacterinas, en el caso de Salmonella Enteritidis pueden contener uno o más fagotipos, y diferentes cepas en el caso de Salmonella Typhimurium, que pueden variar de acuerdo con el fabricante.
Muchos estudios publicados, han demostrado una eficacia variable de estos productos; debido a que productos inactivados usualmente producen una respuesta humoral con pobre o inconsistente efecto en la protección, especialmente en lo relacionado a excreción, diseminación y protección de la progenie en las primeras semanas de vida. Un estudio demostró que la vacunación con reproductoras no afecta los niveles de la cepa de desafío en el contenido cecal o en los órganos internos hasta las dos semanas de edad. Es necesario tener en cuenta que, por las características de la colonización intestinal de Salmonella y por su característica de intracelular facultativo, el efecto protector de los anticuerpos circulantes estimulados por la utilización de vacunas inactivadas solamente es eficiente durante la circulación de la bacteria o fase extracelular.
Una de las mayores ventajas en relación a los productos inactivados es la ausencia de un microrganismo vivo que podría eventualmente sobrevivir en el medio ambiente y causar riesgo de contaminación o exposición para otras especies animales. Sin embargo, su eficacia está limitada, si es sabido que niveles de anticuerpos circulantes contra Salmonella no es una medida de protección eficaz. En esa misma línea de raciocinio las vacunas inactivadas son insuficientes en la activación de células Th1 (linfocito T helper 1) relacionados directamente con la inmunidad mediada por células, confiriendo por lo tanto una protección parcial contra la colonización intestinal excreción fecal, diseminación sistémica y transmisión vertical en las aves. En la mayoría de los estudios publicados, la utilización de la vacuna inactivada confiere cierto grado de protección cuando se compara con las aves control no vacunadas, pero esto depende del tipo de desafío, del número de UFC utilizadas para el desafío, y que a pesar que son eficaces, los niveles de protección son variables.
Vacunas vivas
La utilización de vacunas vivas contra Salmonella en aves comenzó en la década del 50 con la cepa 9R de Salmonella Gallinarum. En esta época Smith probó cinco cepas lisas y cuatro cepas rugosas, de las cuales fueron eliminadas por mucha virulencia cuatro cepas lisas y 3 rugosas. La cepa lisa a pesar de la buena inmunidadafectaba negativamente la producción de huevos, lo que no era el caso de la cepa 9R la cual fue utilizada con éxito en los casos de tifosis aviar, aunque la naturaleza de su atenuación sea desconocida hasta hoy. Algunas otras cepas fueron desarrolladas, como la mutante aroA, nuoG, crp, metC o la deletada cobS/ cibA, sin embargo no se utilizan comercialmente.
CUADRO 1. Vacunas inactivadas contra Salmonella registradas en el SENASICA en México.
|
VACUNA |
EMPRESA |
SEROVAR – SEROVARES |
|
Layermune SE |
Ceva Salud Animal S.A. de C.V. |
SE |
|
Cevac Corymune 4K |
Ceva Salud Animal S.A. de C.V. |
SE |
|
Cevac Corymune 7K |
Ceva Salud Animal S.A. de C.V. |
SE |
|
Avipro 109 SE Conc |
Lohmann Animal Health S.A. de C.V. |
SE |
Fuente: http://www.senasica.gob.mx/?id=5194 (Marzo 2015).
En el caso de las Salmonella paratíficas, la utilización de vacunas en aves comenzó en la década de los 90 en Europa. El uso de estos productos se extendió para las reproductoras y ponedoras, y en algunos casos pollos de carne. Las vacunas vivas atenuadas son elaboradas a partir de cepas con mutaciones naturales o inducidas, manipulación genética en genes esenciales para el metabolismo bacteriano o su sobrevivencia o virulencia en el hospedero. Todas las vacunas vivas atenuadas han sido desarrolladas para la administración por la vía oral, lo que facilita la administración en aves de cualquier edad, y la inducción de una inmunidad protectora humoral, celular y en las mucosas. Estos productos, independientemente de la cepa utilizada en su fabricación, presentan excelentes resultados de protección porque la vacunación estimula el sistema inmune local representado por el sistema común de las mucosas y la consecuente producción de SIgA específica.
CUADRO 2. Algunas vacunas vivas atenuadas utilizadas en el mundo.
|
SEROTIPO DE SALMONELLA |
CEPA |
VÍA DE ADMINISTRACIÓN |
|
Enteritidis |
Salmonella Enteritidis cepa mutante metabólica |
Oral |
|
Salmonella Enteritidis cepa 441/014 auxotrófica para adenina e histidina |
Oral |
|
| Gallinarum | Salmonella Gallinarum cepa 9R | Subcutánea o intramuscular. |
|
Typhimurium |
Salmonella Typhimurium cepa mutante genética por deleción. |
Oral/Spray |
|
Salmonella Typhimuirum mutante metabólica |
Oral |
|
|
Salmonella Typhimurium mutante aromática |
Spray |
|
|
Salmonella Typhimurium mutante química |
Oral/Spray |
|
|
Salmonella Typhimurium fago DT9 auxotrófica para adenina e histidina |
Oral |
Estos productos aumentan la respuesta mediada por células, con un aumento en la eliminación de Salmonella Enteritidis. La potencial superioridad de las vacunas vivas atenuadas ha servido de punto de partida a investigaciones dirigidas al desarrollo de cepas mutante de Salmonella que puedan ser utilizadas en medicina humana y veterinaria. Por ejemplo a S. Typhimuirum aroA, cepa que carece de capacidad de replicación en el hospedero por la ausencia de algunos metabolitos necesarios para el crecimiento bacteriano. Las mutantes con el sistema PhoP/PhoQ no funcional, son altamente atenuadas in vivo, este sistema está asociado con la resistencia de la bacteria a los mecanismos innatos de defesa. Otro ejemplo son las cepas deficientes en el loci SPI2 (isla de patogenicidad 2) no sobreviven en los fagocitos, debido a que este sistema es requerido para la infección sistémica y la sobrevivencia bacteriana en los fagocitos.
En 2100, Methner y colaboradores desarrollaron una mutante deletada phoP/fliC que fue evaluada como candidata a vacuna viva en aves. La proteína fliC es el mayor componente del flagelo de Salmonella importante para la adherencia, mientras que el phoP es parte del sistema de regulación que también juega un papel importante en la virulencia. Esta cepa tiene una ventaja importante en relación a su inocuidad, que permite diferenciar la cepa vacunal de las cepas de campo por la ausencia del fliC.
Las vacunas vivas se utilizan extensamente en una buena parte de los países del mundo, con el objetivo dirigido especialmente a la salud pública y seguridad de los consumidores de productos y subproductos avícolas.
Vacunas subunidades
Estos productos están registrados solamente para su uso en humanos. Son inocuos y producidas del polisacárido de la cápsula en el caso de Salmonella Typhi. En aves algunas fueron probadas con éxito, como las proteínas de membrana externa, pero no fueron desarrolladas comercialmente. Otras han sido estudiadas pero tienen dos limitaciones, la primera es que necesitan de adyuvantes adecuados debido a su pobre inmunogenicidad, y la segunda que se aplican vía parenteral. Hay algunos en fase de investigación y desarrollo que se detallan a en el cuadro 3.
CUADRO 3. Algunas vacunas subunidades en fase de investigación.
|
PROTEINA |
SEROVAR – SEROVARES |
|
Proteína de membrana externa |
SE |
|
FliC (proteína flagelar) |
SE |
|
Fimbria tipo I |
SE |
|
Proteínas de SPI-1 e SPI-2 |
SE |
Otras vacunas
Otras vacunas son las producidas con ADN en vectores de plásmidos en los cuales se insertó un gen que codifica alguna proteína o antígeno vacunal de algún microrganismo patógeno para el cual se busca proporcionar protección. La expresión genética se realiza con la influencia de un promotor eucariótico que permite la síntesis de proteína transgénica en las células que son transfectadas “in vivo” después de la inyección del vector plásmido. La característica de estos productos es que constituyen un estímulo muy potente para la generación de respuestas celulares que hasta hoy solamente fueron obtenidas utilizando vacunas con microrganismos vivos. En veterinaria, tres productos han sido registrados basados en esta tecnología, uno de ellos para equinos (virus del oeste del Nilo), otro para salmones (necrosis hematopoyética infecciosa) y la última para perros (melanoma). En el caso de Salmonella, existe un estudio en ratones que examina la eficacia de una vacuna ADN que codifica SPI-1 de Salmonella o sopB, con excelente resultados.
Vacunas recombinantes, es una interesante área de investigación. Se demostró en un estudio de Zhou y colaboradores (2007) la utilización de vector de adenovirus recombinantes que consiguieron expresar la mayor proteína de membrana externa de Chlamydophylla psittaci y proteger las aves vacunadas frente a un desafío oral. Este es un campo de muchas posibilidades de éxito en la prevención y control de la salmonelosis de las aves, y que debería ser motivo de investigación especialmente en el desarrollo de productos contra varios agentes patógenos y así facilitar el manejo de la vacunación en la industria avícola.
MECANISMOS DE PROTECCIÓN E INMUNIDAD
El cuadro 4, muestra las diferencias en la activación del sistema inmune y de los participantes de la respuesta inmune, que explica por qué la eficacia de las vacunas vivas es superior a las vacunas inactivadas en varios aspectos, especialmente en reducir la colonización y excreción, en activar la respuesta inmune mediada por células y en generar clones de células memoria.
CUADRO 4. Diferencias de activación del sistema inmune en las aves entre vacunas vivas e inactivadas.
|
PARTICIPANTES/ACTIVIDAD |
VACUNAS INACTIVADAS |
VACUNAS VIVAS |
|
CPA1 Reconocimiento |
SI |
SI |
|
CPA1 Procesamiento |
SI |
SI |
|
Presentación al LT colaboradores (LT helper) |
MHCII |
MHCI |
|
Activación de LTh |
CD4+ (Th2) |
CD4+ (Th1) |
|
Citocinas mediadoras |
IL-4, IL-5, TGF-δ, IL-10 |
IFN-γ, TNF-α, IL-2 |
|
Células efectoras |
LB plasmocitos |
LT (CD8+ CTL) |
|
Células memoria |
Clones LB |
Clones LT |
|
Respuesta Inmune |
Humoral sistémica |
|
|
(Ac circulantes) |
Celular |
|
1CPA=células presentadoras de antígenos (células dendríticas, macrófagos y linfocitos B).
Después de la inmunización con una vacuna viva atenuada de Salmonella, se desarrolla la memoria inmunológica con clones de LT. Las respuestas séricas y de la mucosa obtenidas por las vacunas vivas son directamente dirigidas a un amplio espectro de antígenos. En animales y humanos expuestos a una vacuna viva contra Salmonella, las respuestas inmunes son iniciadas por linfocitos ayudadores de la subpoblación Th1, directamente relacionada con la inmunidad mediada por células, que es la responsable de la eliminación de organismos intracelulares como la Salmonella. Se debe tener en cuenta que dependiendo de los serotipos de Salmonella se observarán diferencias en las respuestas inmunes, y en aves se pueden establecer dos modelos básicos relacionados a las salmonelas hospedero-específicas (S. Gallinarum y S. Pullorum), y a los grupos inespecíficos (S. Enteritidi
, S. Typhimurium y otras). Es necesario mencionar también que la respuesta inmune a antígenos complejos es raramente exclusiva mediada por Th1 o Th2, sin embargo existe una combinación y dominancia de algunas citosinas que dirigen la respuesta a una respuesta predominantemente humoral o celular.
El cuadro 5, muestra las diferencias en la activación del sistema inmune y de los participantes de la respuesta inmune, que explica por qué la eficacia de las vacunas vivas de administración oral es superior a las vacunas vivas inyectables en varios aspectos, especialmente en reducir la colonización y excreción, en activar la respuesta inmune mediada por células y específica en las mucosas.
CUADRO 5. Diferencias de activación del sistema inmune en las aves entre vacunas vivas e inactivadas.
| PARTICIPANTES/ACTIVIDAD |
VACUNAS VIVAS INYECTABLES |
VACUNAS VIVAS ORALES |
|
TLR5 reconocimiento |
NO |
SI |
|
CPA1 Reconocimiento |
SI |
SI |
|
CPA1 Procesamiento |
SI |
SI |
|
Presentación al LT colaboradores (LT helper) |
MHCI |
MHCI |
|
Activación de LTh |
CD4+ (Th1) |
CD4+ (Th1) |
|
Citocinas mediadoras |
IFN-γ, TNF-α, IL-2 |
IFN-γ, TNF-α, IL-2 |
|
Células efectoras |
LT (CD8+ CTL) |
LT (CD8+ CTL) |
|
Células memoria |
Clones LT |
Clones LT |
|
Respuesta Inmune |
Celular |
Celular |
|
Mucosas |
1CPA=células presentadoras de antígenos (células dendríticas, macrófagos y linfocitos B).
Administrando la bacteria oralmente en aves recién nacidas, el resultado es una extensa colonización del intestino y un fuerte estímulo de la respuesta inmune adquirida, en aves que son inmunológicamente inmaduras. Sin embargo, la colonización ejerce una variedad de eventos con una rápida respuesta protectora dentro de un máximo de 24 horas. Esto incluye la inhibición específica de la colonización, por el mecanismo de exclusión competitiva, en el cual la bacteria protectora ejerce una resistencia profunda al establecimiento y colonización de otra bacteria relacionada.
Este debe ser un atributo primario de la cepa vacunal que también puede envolver competencia por los lugares de colonización. La presencia de una gran cantidad de bacterias vacunales en el intestino puede inducir la infiltración de heterófilos en la pared intestinal, lo que proporciona resistencia no sólo a la invasión sino a la diseminación sistémica de una cepa patógena. Esto abre la perspectiva para el uso de vacunas en pollos de carne o asaderos, ponedoras y reproductores; pero también en otros animales que muestran susceptibilidad aumentada a la infección por su juventud o por otras razones, como la profilaxia o antibioticoterapia, donde la pérdida de la microflora nativa intestinal es una cuestión que deja abierta las puertas para la instalación de patógenos, especialmente los entéricos.
Las vacunas vivas atenuadas de administración oral reproducen la vía natural de infección, con lo que se tornan los productos más adecuados para la estimulación de la inmunidad de las mucosas; con lo cual existe una colonización previa del intestino con la cepa vacunal que ejerce un efecto similar al producido por los productos de exclusión competitiva, con la ventaja de que con la vacunación oral se estimula el sistema inmune sistémico, el sistema inmune local de la mucosa intestinal, con la activación del sistema linfoide asociado al intestino (GALT) y la consecuente respuesta específica. La inmunidad generada en las mucosas es un factor importante en el sistema inmune, pues puede reflejar en la inmunidad en otros tejidos o sistemas fisiológicos del organismo, contra agentes infecciosos. La respuesta inmune intestinal contra Salmonella abarca una serie de interacciones complejas, que incluyen, citrinas, linfocitos, células epiteliales y otros factores presentes en el ecosistema intestinal.
El sistema inmune común de las mucosas propuesto por Biennestock en 1974 está respaldado por una serie de investigaciones que demuestran que este sistema ha evolucionado paralelamente con el sistema inmune sistémico, como consecuencia de esta dicotomía, solamente las respuestas iniciadas en los lugares inductores de la mucosa pueden resultar en una respuesta inmune eficaz. El sistema inmune secretor proporciona una red integrada ligada de órganos de las mucosas que trabajan independientemente de la inmunidad sistémica. Este concepto de “sistema inmune común de las mucosas”, está respaldado por la migración de células efectoras y la secreción de moléculas de SIgA que aseguran que la experiencia antigénica en una mucosa puede ser reflejada en la expresión del sistema inmune efector en una superficie distante. Por ejemplo, la estimulación del sistema inmune en el intestino puede resultar en la producción y detección de anticuerpos específicos en la tráquea, o la inmunización intraocular puede producir un estímulo a nivel del tracto gastrointestinal en aves, con la producción de IgA e IgG en niveles significativos.
La ruta de administración de una vacuna es de vital importancia e influencia en la respuesta inmune en el lugar donde el patógeno invade y donde la protección debe ser más eficaz, especialmente para agentes intracelulares como la Salmonella. Esta bacteria requiere de estrategias de vacunación que activen herramientas múltiples del sistema inmune tanto la inmunidad innata como la adquirida. Ha sido ampliamente demostrado que la respuesta inmune protectora en las mucosas son más eficaces cuando son inducidas por esa misma vía, es decir a través de vacunaciones orales, intranasales o intracloacasis, porque el sistema común de las mucosas en las aves ha sido demostrado y las respuestas incluyen no sólo el sistema inmune innato, como la producción de anticuerpos en la mucosa SIgA especialmente y linfocitos citotóxicos localizados en los tejidos próximos a la inmunización necesarios para una protección eficaz. Como las superficies mucosas son el mayor lugar de entrada de muchos agentes infeccosos, es importante el conocimiento del sistema inmune intestinal para entender los mecanismos de protección de las vacunas y las nuevas estrategias de protección utilizando productos vivos atenuados aplicados por la ruta natural de infección.
PROTECCIÓN HOMÓLOGA Y HETERÓLOGA
La vacunación por Salmonella es una parte de un programa adecuado de prevención. Las vacunas vivas producen una mejor protección que las vacunas inactivadas (muertas), y la vacunación con vacunas vivas orales lideran la inducción de una fuerte inmunidad en aves vacunadas a nivel sistémico y de mucosas. La protección conferida por la vacunación oral con salmonelas homólogas ha demostrados que induce protección contra la invasión de los órganos por la cepa de desafío, con una reducción de la colonización del tracto gastrointestinal
Para discutir sobre protección homóloga o heteuróloga, es necesario definir ambas palabras desde el punto de vista científico:
A) HOMÓLOGO: una grado de similitud, como una posición o estructura, y que puede indicar un origen común / un estado de similitud en estructura o posición anatómica pero no necesariamente función entre diferentes organismos indicando un ancestro común u origen de evolución. B) HETERÓLOGO: de diferente origen / falta de correspondencia de similitud orgánica de estruc- turas como resultado de un origen diferente de las partes constituyentes.
Ambas palabras pueden ser usadas para protección en el caso de Samonella, y esta protección podría ser explicada como se detalla en las siguientes figuras. Los ejemplos muestran dos vacunas de diferentes grupos antigénicos.
Las vacunas de Salmonella Enteritidis pueden proporcionar protección contra el mismo serovar de Salmonella y contra serovares similares del mismo grupo (Figura 1), siguiendo la definición anterior protección “homóloga”. Methner et al. (1997) indicaron que la inoculación con vacunas de Salmonella Typhimurium resultaba en una disminución significativa de la colonización por Salmonella Typhimurium (protección homóloga), y colonización por Salmonella Enteritidis podría no ser disminuida por la misma cepa de Salmonella Typhimurium (protección heteróloga).
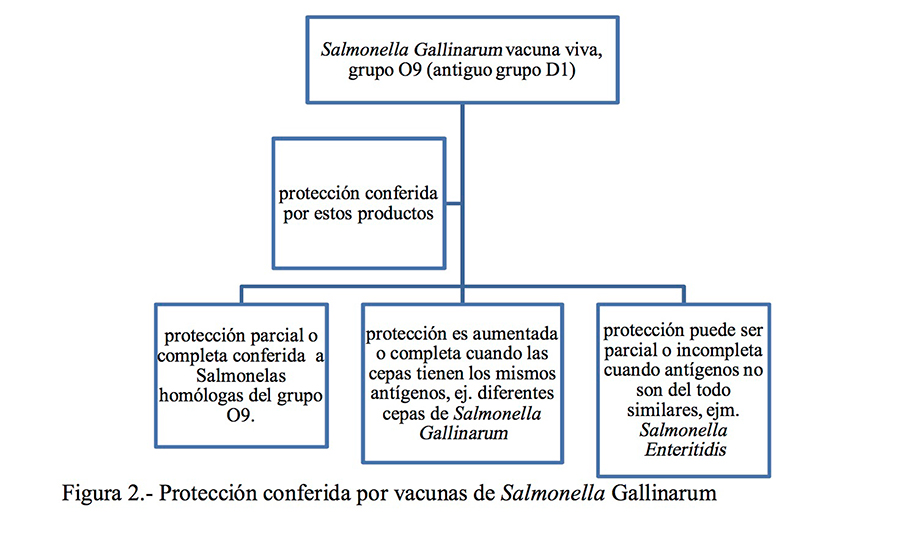
La protección homóloga fue descrita por Chacana & Terzolo (2006) en un ensayo utilizando una vacuna viva atenuada de Salmonella Enteritidis contra tifosis aviar en aves (Figura 1). En el caso de Salmonella Gallinarum (SG), esta bacteria es diferente del resto de serovares de Salmonella conocidos, es el único serovar altamente específico para aves incluyendo los dos biovares Gallinarum and Pullorum (Eswarappa et al., 2009). Las vacunas vivas han sido utilizadas en este caso de 1956 para prevenir la tifosis aviar, cuando una vacuna rugosa de Salmonella Gallinarum fue desarrolla- da en 1956. Más investigación fue realizada en la última década, y en 2010 Penha Filho et al., probaron una cepa mutante de Salmonella Gallinarum contra un desafío de una SG salvaje, mostrando que la protección homóloga reducía la mortalidad en 50% en el grupo vacunado cuando se comparó con el grupo no vacunado, sugiriendo que esta vacuna experimental parece poseer mejores características de inmunogenicidad, siendo capaz de conferir una rápida y más específica respuesta contra este serovar (Figura 2). En 2013 Shehata y colaboradores probaron una vacuna de SG mutante metabólica atenuada viva con un marcador de atenuación simple o doble, y mostraron protección homóloga y limpieza de la cepa de
desafío de Salmonella utilizada 14 días post-desafío, lo cual puede ser atribuido a la remoción de la cepa de desafío por la inmunidad mediada por células.
A pesar del hecho que Wigley et al. (2006) demostraron que la primovacunación con Salmonella Typhimurium o Salmonella Enteritidis activa una protección cruzada reactiva fuerte y una protección considerable al desafío con cualquiera de los serovares, sugiriendo conservación de los antígenos protectores; vacunas de Salmonella Enteritidis o Typhimurium podrán proporcionar protección heteróloga contra otros serovares/ serogrupos. Evidencia en el campo indican que esta protección puede ser variable y casi siempre envolver protección parcial o pequeña contra la colonización de los ciegos, invasión de los órganos (bazo, hígado, ovarios) y excreción fecal.
Salmonella tiene regiones altamente variables y serológicamente dominantes: la cadena lateral O. De acuerdo a la estructura del antígeno O los serovares de Salmonella son diferentes, con determinación de la especificada serológica del antígeno flagelar (H) expresado en dos fases. Las diferenciaciones serológicas de los antígenos O son designados por un número. Salmonella Typhimurium tiene la fórmula antigénica 1, 4, 5, 12, y antígenos 4 y 12 son encontrados en todos los serovares del grupo O4. Salmonella Enteritidis tiene la fórmula antigénica O 1, 9, 12; y los antígenos 9 y 12 son encontrados en todos los serovares del grupo O9.
En relación a la protección homólogas y heteróloga, Hassan y Curtis publicaron en 1994 el desarrollo y evaluación de un programa de vacunación experimental usando una vacuna viva avirulenta de una cepa de Salmonella Typhimurium para proteger aves inmunizadas contra el desafío con serotipos homólogos y heterólogos de Salmonella. En este estudio, los resultados mostraron que la protec- ción homóloga conferida por la vacuna Δcya Δcrp de Salmonella Typhimurium fue mejor contra cepas homólogas (cepa S. Typhimimurium F98), y que a pesar de haber protección para los serovares del mismo grupo O4 como Heidelberg, Agona y Bredenet, la protección no fue la misma que cuando las aves fueron desafiadas con Salmonella Typhimurium (F98). La protección fue variable y significativamente menor en aves vacunadas con Δcya Δcrp de Salmonella Typhimurium desafiadas con otros salmonelas de otros grupos (Δcya Δcrp de Salmonella Typhimurium (O:7 Infantis, Montevideo; O:8 Albany o Hadar; O:9 Enteritidis o Panama; O:3,10 Anatum), confirmándose que la protección homóloga es mejor que la heteróloga ,y que existió protección en todos los grupos cuando se compararon con las aves no vacunadas.
Holt y colaboradores (2003), reportaron un pequeño efecto de la vacuna viva Δcya Δcrp Salmonella Typhimurium en la transmisión del Salmonella entre aves desafiadas con Salmonella Enteritidis y aves contacto en la reducción de la excreción fecal de Salmonella Enteritidis después de la vacunación de ponedoras, indicando que la protección heteuróloga no tiene una buena eficacia para proteger aves contra Salmonella.
Analizando los resultados de Hassan y Curtiss (1994), puede ser observado que cuatro serotipos usados para el desafío pertenecen al grupo O4 (antiguo grupo B), dos al grupo O7 (antiguo C1), dos al grupo O8 (antiguos C2-C3), dos al grupo O9 (antiguo D1), y uno al grupo O:3,10 (antiguo E1), como se detalla en la Tabla 1. Los resultados relacionadas a protección fueron eficaces cuando las aves fueron desafiadas con la cepa homóloga (Salmonella Typhimurium F98), y no hubo el mismo resultados en el grupo desafiado con Salmonella Panama perteneciente al mismo grupo O9, a pesar del hecho que ella pertenecen al mismo grupo O9, pero ambos serovares tienen diferencias en antígenos somáticos, flagelares y otros antígenos (Tabla 1), que pueden ser responsables por la protección parcial. Los autores concluyeron que usando una vacuna oral viva Δcya Δcrp Salmonella Typhimurium al 1 y 14 días de edad se induce una fuerte protección contra la colonización e invasión de aves vacunadas por cepas homólogas de Salmonella con antígeno de grupo O9 (antiguo grupo B).
TABLA 1.- Grupos vacunados con vacuna de Salmonella Typhimurium Δcya Δcrp y desafiados con diferentes serotipos de Salmonella.
|
SEROTIPO DE SALMONELLA |
GRUPO |
ANTÍGENO SOMÁTICO (O) |
ANTÍGENO FLAGELAR (H) |
OTROS |
|
|
FASE 1 |
FASE 2 |
||||
| Typhimurium |
O4 |
1,4,[5],12 |
I |
1,2 |
|
| Heidelberg | O4 | 1,4,[5],12 | R | 1,2 | |
| Agona |
O4 |
1,4,[5],12 |
f,g,s |
[1,2] |
[z27],[z45] |
| Bredeney |
O4 |
1,4,12,27 |
1,v |
1,7 |
[z40] |
| Infantis |
O7 |
6,7,14 |
R |
1,5 |
[R1…],[z37],[z45], [z49] |
| Montevideo |
O:7* |
6,7,14 |
g,m,[p],s |
[1,2,7] |
|
| Albany |
O:8 |
8,20 |
z4,z24 |
– |
[z45] |
| Hadar |
O:8 |
6,8 |
z10 |
e,n,x |
– |
| Panama |
O:9 |
1,9,12 |
1,v |
1,5 |
[R1…]** |
| Anatum |
O:3,10 |
{10}{15}{15,34} |
e,h |
1,6 |
[z64] |